電子軌道と遷移元素
遷移元素では最外殻より内側の電子殻に電子が配置されていきます。なぜ最外殻じゃないのでしょうか。 今回は,遷移元素と電子軌道を関連づけてその謎を解いてみたいと思います。
遷移元素
電子軌道は,
K殻:1s軌道
L殻:2s,2p軌道
M殻:3s,3p,3d軌道
N殻:4s,4p,4d,4f軌道
というようにあります。
電子はエネルギー準位の低い電子軌道から順に配置されていきます。
そのほうが安定するからです。
ということで,電子軌道をエネルギー準位の低い順に並べてみます。
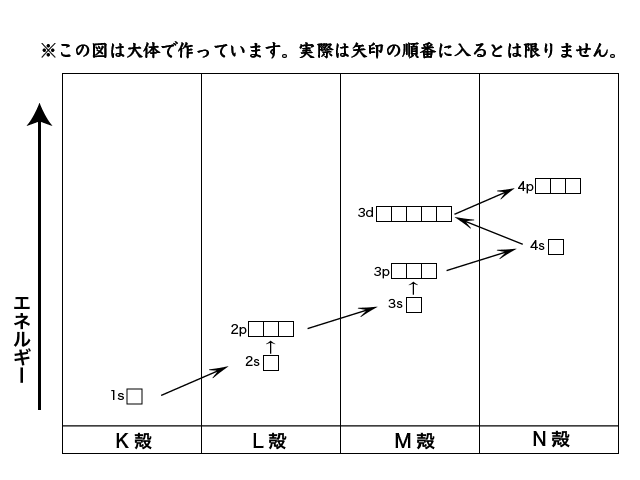
こんな感じです。
ここで,M殻の3d軌道とN殻の4s軌道に注目すると,3d軌道より4s軌道の方がエネルギーが低くなっています。
従って,3d軌道よりも先に4s軌道に電子が配置されます。
M殻が満たされる前にその外側のN殻に電子が入っていくってことです。
じゃあ4s軌道の後はどこに電子が配置されるでしょうか。
はい,3d軌道です。4p軌道よりエネルギーが低いからです。
つまり,最外殻(この場合はN殻)よりもひとつ内側の電子殻に電子が配置されていきます。
これが遷移元素の正体です。
まあ実際は綺麗な順番で入らないこともあって,例えばs軌道の電子が1つだけどp軌道の電子が配置されるってこともあります。
詳しい電子配置が知りたい方は,Wikipedia-電子配置を見てみてください。
周期表上でも確認してみましょう。第4周期に注目してください。
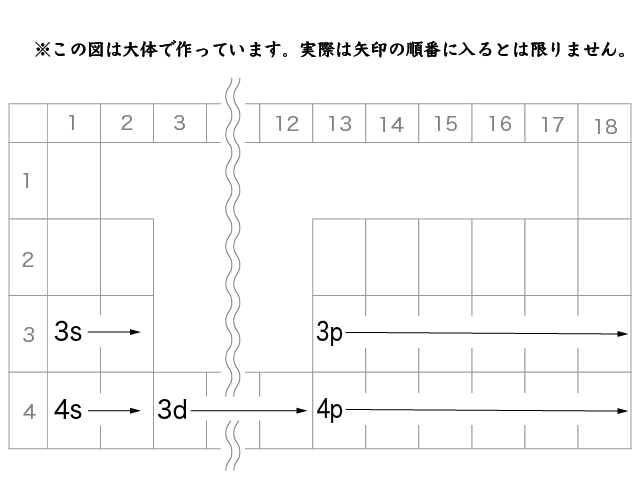
1・2族では4s軌道に電子が配置されます。
3〜12族では,最外殻から1つ内側の電子殻にある3d軌道に電子が入っていきます。
13族からは,また最外殻の4p軌道に電子が配置されていきます。
ついでに希ガスについてなんですが,18族元素は第1周期を除いてs軌道とp軌道が埋まっているってことに気づかれましたか?
第1周期はs軌道しかないのでアレなんですが,第2周期ではL殻の2s軌道と2p軌道が埋まって閉殻に,
第3周期以降はs軌道とp軌道が埋まってオクテットになっています。
内部遷移元素
次はランタノイドやアクチノイドといった内部遷移元素についてみていきます。
以下の図は,第5周期から第6周期の電子軌道のエネルギー準位を表したものです。(K,L,M殻は省略しています)
第6周期はランタノイドを含みます。
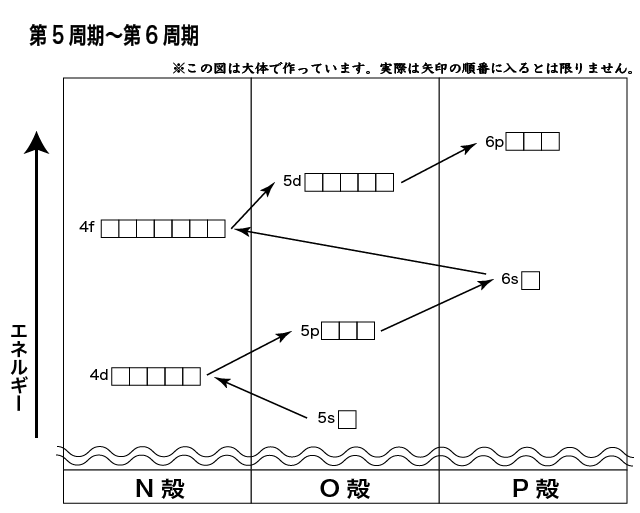
まず第5周期では,第4周期と同じような感じで5s→4d→5pの順で電子が配置されます。
N殻には4f軌道がありますが,それよりも6s軌道の方がエネルギーが低いので先に6s軌道に電子が入ります。
これが第6周期の1族・2族の元素(Cs,Ba)です。
6s軌道が埋まると,4f軌道に電子が入り始めます。この最外殻から2つ内側の4f軌道に電子が配置される元素がランタノイドです。
(ランタン(La)は5d軌道に入るんですけどね…)
周期表では3族のところにまとめられています。
4f軌道が満たされると,5d→6pの順に配置されて行ってオクテットになります。
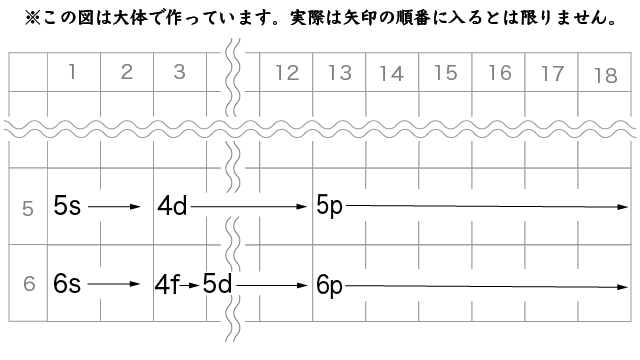
こんな感じで,最外殻より2つ内側の電子殻のf軌道に電子が配置されるのが内部遷移元素です。
しかし,こちらも綺麗な順番で入っていかないこともあります。詳しくはWikipedia-電子配置を見てください。
まとめ
今回は,遷移元素と電子軌道の関係についてみてきました。
なんで電子殻に電子が入る順番が前後するのか,電子軌道から考えていくと分かりやすくなったと思います。
他のページでは共有結合と電子軌道の関係をまとめておりますのでよかったら見て行ってください。