- Binary notes
- 高校の勉強
- 化学
- 酸化還元反応の基礎
酸化還元反応 - 復習
『物質が酸素と化合した時、その物質は酸化されたといい、
また、物質が酸素を失ったとき、その物質は還元されたという。』
このことは中学校で学んだ記憶があります。
また、酸化と還元は必ず同時に起こる、とも学びました。
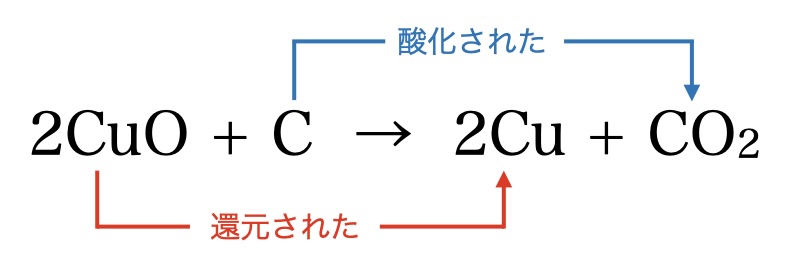
筆者は酸素と化合するから酸化っていう感じでやったような記憶があります。
しかし、高校では酸素が全く関わらないところにも酸化還元反応の考え方を適用していきます。
というわけで、次章からそれらについて見ていきます。
酸化還元反応と水素
今、ここに硫化水素 H2S があります。
これと、酸素 O2を反応させます。
反応式は、以下の通りになります。
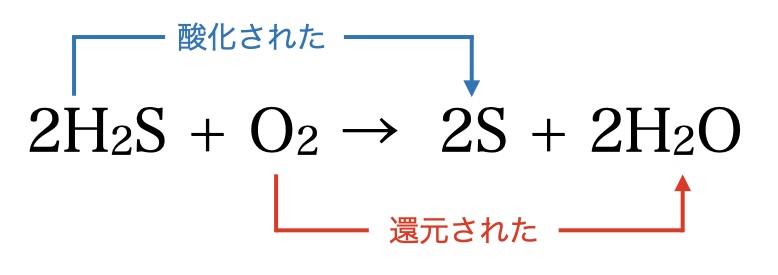
ここで、何が酸化されて何が還元されたのか見ていきます。
硫化水素に酸素を反応させたので、「硫化水素は酸化された」と言いたいですが、なんか違う感じがします。
硫化水素と酸素が化合しているわけではないのでモヤモヤするわけです。
そこで、水素の授受に着目して酸化還元反応を考えることにします。
ある物質が水素を失った時 その物質は酸化されたと言い、水素と化合した時その物質は還元されたと言うことになりました。
その他の物質の酸化還元反応
さて、ここからは酸素が関係しない酸化還元反応を考えていきます。 すごく意味不明なことを言っていますが、順番にやっていきます。
まずは、酸化還元反応における電子のやり取りを確認します。
ここにテルミット反応の化学式があります。
テルミット反応では、アルミニウムは酸化される一方 酸化鉄は還元されて単体の鉄に変化します。

酸化鉄(Ⅲ) は、Fe3+ と O2- が 2:3の割合でくっついたものです。
この反応において、電子のやり取りを整理してみると以下のようになります
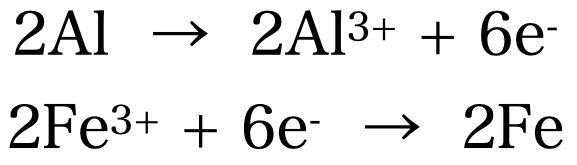
アルミニウムは原子1個あたり3個の電子を失いアルミニウムイオン(Al3+)になる一方、
酸化鉄中の鉄イオン(Fe3+)は原子1個あたり3個の電子を受け取って単体の鉄に変化します。
ここで、酸化還元反応を電子のやり取りを元に定義します。
ある物質が電子を失った時 その物質は酸化された、
ある物質が電子を受け取った時 その物質が還元された、と言うことになりました。
こうすることで、さまざまな反応を酸化還元反応として説明することができるようになりました。