中和
目次
中和反応とは
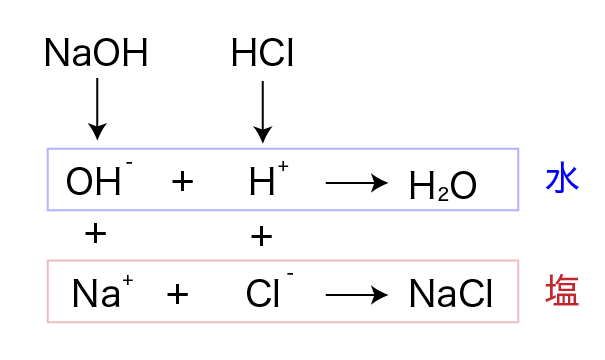
中和とは、酸と塩基が互いの性質を打ち消す反応です。 例えば、塩酸と水酸化ナトリウム水溶液を混ぜると、下のような反応が起こります。
HCl + NaOH → H2O + NaCl
2つの水溶液を混合した段階ではナトリウムイオンと塩化物イオンは反応しません。
それぞれ溶液中にイオンのままで存在します。
中和後の溶液から水を蒸発させると塩化ナトリウムの結晶が現れます。
上の反応では、HCl の水素イオンと NaOH の水酸化物イオンが反応して水が生成するとともに、
残されたナトリウムイオンと塩化物イオンが結合して塩化ナトリウムが生成します。
この塩化ナトリウムのように、中和反応によって水とともに生成する物質を塩といいます。
水を生成しない中和反応
気体の塩化水素とアンモニアを空気中で反応させると、塩化アンモニウムの白煙を生じます。 これを化学反応式で表すと、以下のようになります。
HCl + NH3 → NH4Cl
この反応も中和反応ですが、生成するのは塩(塩化アンモニウム) のみで、水は生成されません。
中和反応の中には、水の生成を伴わないものもあります。
塩
それでは、次に中和反応によって生成される塩について説明していきたいと思います。
塩の分類
正塩
完全に中和した時に生じる塩で、化学式中に酸の H や塩基の OH が全く残っていない塩を 正塩 といいます。
1価の酸と1価の塩基の中和反応では、生成する塩は全て正塩です。
酸性塩
2価以上の酸を不完全に中和した時に生成する塩で、化学式中に酸の H が残っている塩を 酸性塩 といいます。
一つ例を挙げてみます。
H2CO3 + NaOH → NaHCO3 + H2O
2価の酸である炭酸を、1価の塩基である水酸化ナトリウムで中和しようとしています。
塩基が足りていないので、完全には中和されず、化学式中に H が残った炭酸水素ナトリウム(NaHCO3)が生成します。
炭酸水素ナトリウムは酸性塩に分類されます。
今度は完全に中和していきましょう。
H2CO3 + 2NaOH → Na2CO3 + 2H2O
今度は完全に中和したので、生成した塩(Na2CO3)に酸の H は含まれていません。
炭酸ナトリウムは正塩に分類されます。
塩基性塩
2価以上の塩基を不完全に中和した時に生じる塩で、化学式中に塩基の OH が残っている塩を 塩基性塩 といいます。
これも例を挙げてみます。
Ca(OH)2 + HCl → CaCl(OH) + H2O
2価の塩基である水酸化カルシウムを中和しようとしていますが、酸が十分でないために完全に中和されずに、 化学式の中に OH が残った塩化水酸化カルシウム(CaCl(OH))が生成します。
では、これも酸を十分に増やして完全に中和しましょう。
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
完全に中和したので、正塩である塩化カルシウムが生成しました。
さっきから酸性塩とか塩基性塩とか言っていますが、この酸性や塩基性といった言葉は塩の水溶液の性質とは全く関係がありません。
次は、塩の水溶液の性質についてみていきましょう。
塩の水溶液の性質
では、塩の水溶液が酸性・塩基性どちらの性質を示すのか考えていきましょう。
まず前提として、水はわずかに電離していて、下のような平衡状態にあります。
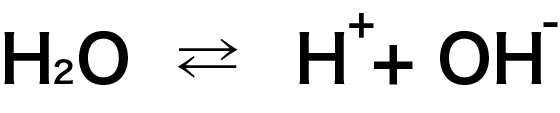
平衡状態とは、上の化学反応式において右方向への変化と左方向への変化の速さが釣り合っていて、外から見た時に反応が止まっているように見える状態のことです。
塩化アンモニウム水溶液
それでは、この水に塩化アンモニウム(NH4Cl)を溶かした時の液性を考えます。
塩化アンモニウムは水に溶けると完全に電離します。
NH4Cl → NH4+ + Cl-
水の電離で生じた水酸化物イオン(OH-)の中には、塩化アンモニウムの電離で生じたアンモニウムイオン(NH4+)と結合するものがあります。
この結合で生じるアンモニア+水が弱電解質であるため、下の式の状態になるからです。

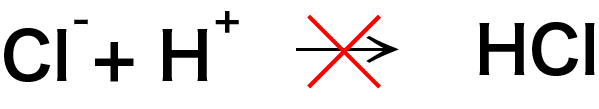
一方、水素イオンと塩化物イオンは反応しません。これらが結合してできる塩化水素は強電解質であるため、水中ではイオンとして存在するからです。
 ※水溶液中
※水溶液中
①の反応により、水中の OH-は減少しますが、 H+はイオンのまま存在するので、
[H+] > [OH-] となります。
OH-が減少したことにより、H2Oの電離が進みますが、供給されるH+と OH-
の数は等しいので [H+] > [OH-] であることに変わりありません。
故に塩化アンモニウムの水溶液は弱い酸性を示します。
酢酸ナトリウム水溶液
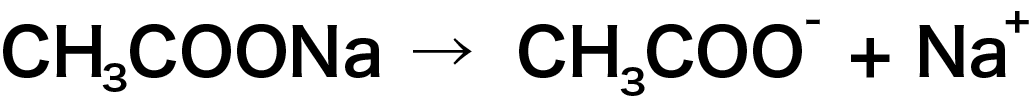
続いて、酢酸ナトリウム(CH3COONa)水溶液について考えます。
酢酸ナトリウムは水に溶けると完全に電離します。
水もわずかに電離しています。
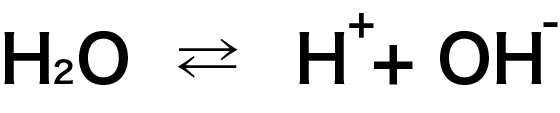
水の電離で生じた水素イオンの一部は、酢酸ナトリウムの電離で生じた酢酸イオン(NH3COO-)と結合するものがあります。
この結合で生じる酢酸が弱電解質であるため、下の式の状態になるためです。

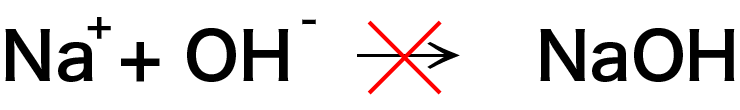
一方、水酸化物イオンとナトリウムイオンは水溶液中では結合しません。 生成する水酸化ナトリウムが強電解質であるため、水溶液中ではイオンとして存在するからです。
 ※水溶液中
※水溶液中
⓵の反応により、水中のH+は減少しますが、 OH-はイオンのまま存在するので、減少しません。
よって、[OH-] > [H+] となります。
故に、酢酸ナトリウムの水溶液は弱い塩基性を示します。
炭酸水素ナトリウム(酸性塩)の水溶液
最後に、酸性塩である炭酸水素ナトリウム水溶液について考えていきます。
炭酸水素ナトリウムも水中で完全に電離します。

さて、ここで生じた HCO3-について、次の2通りの反応が考えられます。
- 水の電離で生じた水素イオンと結合して、炭酸(H2CO3)になる
- HCO3-がさらに電離して、H+ と CO32- になる
1番については、水素イオンを受け取っているので塩基の働きをしていることになります。
2番については、水素イオンを放出しているので酸の働きをしていることになります。
そして、2番は炭酸(H2CO3)の第2電離にあたりますが、これは極わずかしか起こりません。
1番と2番を比べると、1番の塩基の働きの方が大きいです。
と言うことで、これまでと同様に考えていくと、水の電離で生じた H+ の一部は HCO3- と結合して炭酸(H2CO3)になります。 炭酸は弱電解質なので、下の式の状態になります。
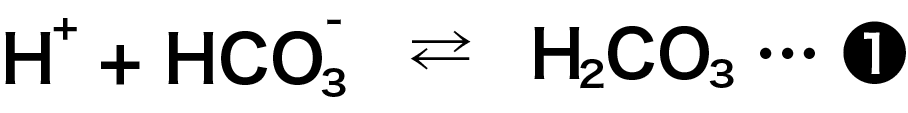
一方、水酸化物イオンとナトリウムイオンは反応しません。
 ※水溶液中
※水溶液中
❶の反応により、水中の水素イオンだけが減少するので、[OH-] > [H-]となります。
故に、炭酸水素ナトリウムの水溶液は弱塩基性を示します。