中和の量的関係と中和滴定
中和に関わる物質の量的関係を使って、溶液の濃度を求めることができます。 今回はその量的関係と、それを利用して溶液の濃度を求める中和滴定について説明します。
目次
中和の量的関係
まずは、中和に関係する酸・塩基の量について考えます。
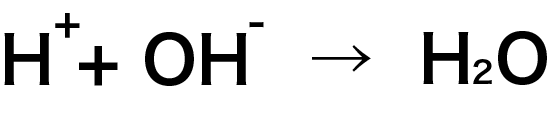
上の式から、H+ と OH- を1:1で混合した時に完全に中和されることがわかります。
H+ と OH- の物質量が等しくなるようにするのですから、以下の関係が成り立ちます。

濃度c(mol/L)の酸の水溶液 v(L)には、cv(mol)の酸が溶けています。
そして、酸の価数を n とします。
また、濃度c'(mol/L)の塩基の水溶液 v'(L)には c'v'(mol)の塩基が溶けています。
そして、塩基の価数を n' とします。
これらを ① 式に当てはめると、以下の式になります。
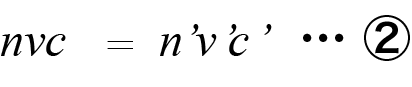
上の式の6つの変数[n, v, c, n', v', c']の内、5つの値が分かれば方程式を解いて残り1つの変数を求めることができます。
例えば、1mol/LのCa(OH)2水溶液100mLを 0.5mol/LのHCl水溶液で中和する時 HCl水溶液は何L必要か、
といった問題を解くことができます。
②式に代入して、
2+HCl.png)
こんな具合です。
弱酸・弱塩基の時
中和の量的関係には、酸・塩基の強弱は関係ありません。
酢酸を水酸化ナトリウムで中和することを考えましょう。
酢酸は弱酸であり、1mol/L水溶液にしたときの電離度は0.004です。
つまり1mol/Lの酢酸水溶液1Lには、0.004molの H+ が存在します。
しかし、0.004molの OH- を含む塩基の水溶液、 例えば1mol/LのNaOH水溶液4mL(0.004L)を加えて中和が完了するかというと、そうではありません。
確かに1mol/LのNaOH水溶液4mLを加えると、はじめに水溶液中にあった H+ は中和されます。
しかし H+ が減少すると、下の式の右向きの反応が進みます。これを平衡が右に移動する、とか言ったりします。
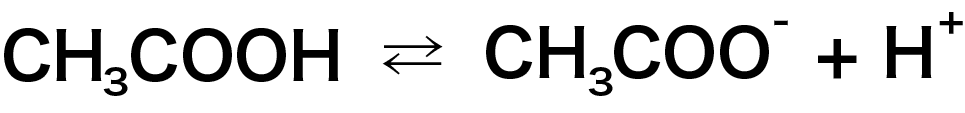
H+ が減少すれば CH3COOH の電離が進んで H+が供給される、
これが水溶液中の酢酸分子がゼロになるまで続きます。
ですから結局、件の酢酸水溶液を完全に中和するには1mol/LのNaOH水溶液が1L必要になります。
というわけで、酸・塩基の強弱は中和の量的関係には影響しません。
中和滴定
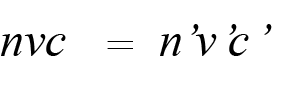
上の式を用いると、水溶液のモル濃度を求めることもできます。
例えば 濃度のわからない H2SO4水溶液100mLを完全に中和するのに、
1mol/LのNaOH水溶液400mLが必要だったとします。
これを代入してやると、
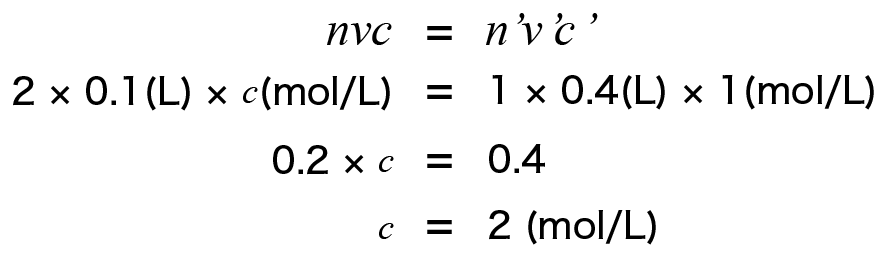
と言った具合に濃度を求めることができます。
今は他の変数を適当に設定しましたが、実際に濃度を求めたい時は、これらの値を実験で調べる必要があります。
この実験操作が 中和滴定 です。
標準溶液
中和滴定で酸[塩基]の濃度を調べるには、まず正確な濃度が分かっている塩基[酸]の溶液が必要です。
この正確な濃度がわかっている溶液のことを標準溶液といいます。
標準溶液の作り方は教科書とかに図付きで載っていると思うのでここで説明はしません。
ただ、標準溶液によく使われる溶質は紹介したいと思います。
酸の標準溶液
酸と聞くと真っ先に塩酸とか硫酸が思いつくかもしれませんが、これらは標準溶液の溶質としては使われません。
なぜかというと、塩酸は揮発性があるため溶質のHClが揮発して濃度が変化しやすいし、
硫酸は空気中の水分を吸うのでこれも濃度が変化しやすいからです。
酸の標準溶液には主に2価の酸であるシュウ酸が使われます。 シュウ酸は塩酸や硫酸とは違い濃度が変化しにくく、また計量もしやすいため正確に滴定することができます。
塩基の標準溶液
塩基の標準溶液には主に水酸化ナトリウムが使われます。 ただし、固体の水酸化ナトリウムは空気と反応して別の物質に変化してしまいます。 計量中にも反応が進んでしまうので、使用前に酸の標準溶液で滴定して正確な濃度を調べることが多いようです。
指示薬の選択
中和が完了したことを知るために、pHによって色が変化する指示薬を使います。
指示薬は滴定する物質に合わせて選択してあげる必要があります。
適切な指示薬を選ぶには、中和滴定をした時のpHの変化を知っておかなければなりません。
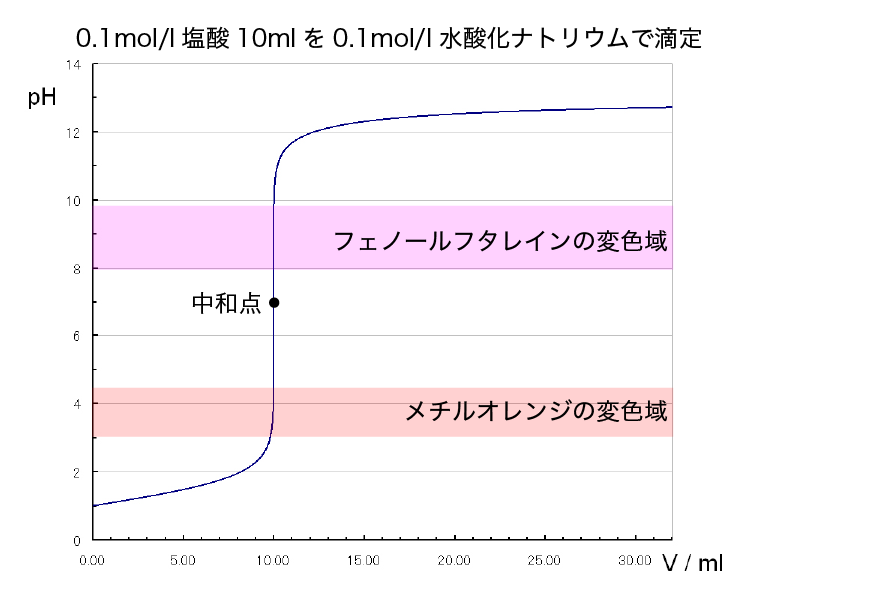
強酸と強塩基の滴定
塩酸を水酸化ナトリウム水溶液で滴定した時、完全に中和する点(中和点)でのpHは7です。 しかし、この中和点を指示薬で正確に検出するのはかなり難しいです。 ではどうすれば良いのか、 NaOHaqの滴下量とpHの関係を示したグラフ(滴定曲線)を見ながら考えます。
塩酸と水酸化ナトリウム水溶液が完全に中和する点(中和点)の前後で、滴定曲線は垂直になっています。
このpHが急激に変化している部分をpHジャンプ(pHjump)といいます。
滴定曲線が垂直になっているので、pHジャンプの領域のどこかと、真の中和点でNaOH水溶液の滴下量は同じということになります。
したがって使用する指示薬は pHジャンプを検出できれば良いわけですから、変色域がpHジャンプの領域にあるものを選択します。
HClaq と NaOHaq の場合は、メチルオレンジやフェノールフタレインを使うことができます。
実験では、フェノールフタレインが使用されることが多いです。
なぜなら、無色→赤色 の変化が肉眼で識別しやすいからです。
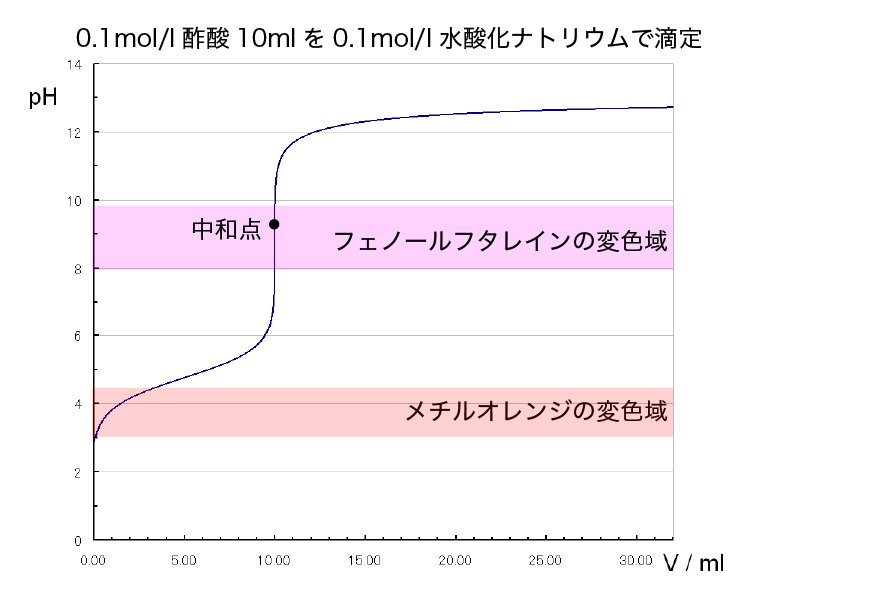
弱酸と強塩基の滴定
今度は酢酸水溶液を水酸化ナトリウム水溶液で滴定する時の指示薬を考えます。
滴定曲線を見ながら考えましょう。
この滴定の場合、pHジャンプは塩基性寄りにあります。
フェノールフタレインは、その変色域がpHジャンプの領域にあるのでこの滴定の指示薬として使用できます。
一方、メチルオレンジは中和点に達する前に色が変わってしまいます。NaOHaqを大体5mLくらい加えたところで変色するでしょうか。
故に、メチルオレンジはこの滴定の指示薬に使用することはできません。
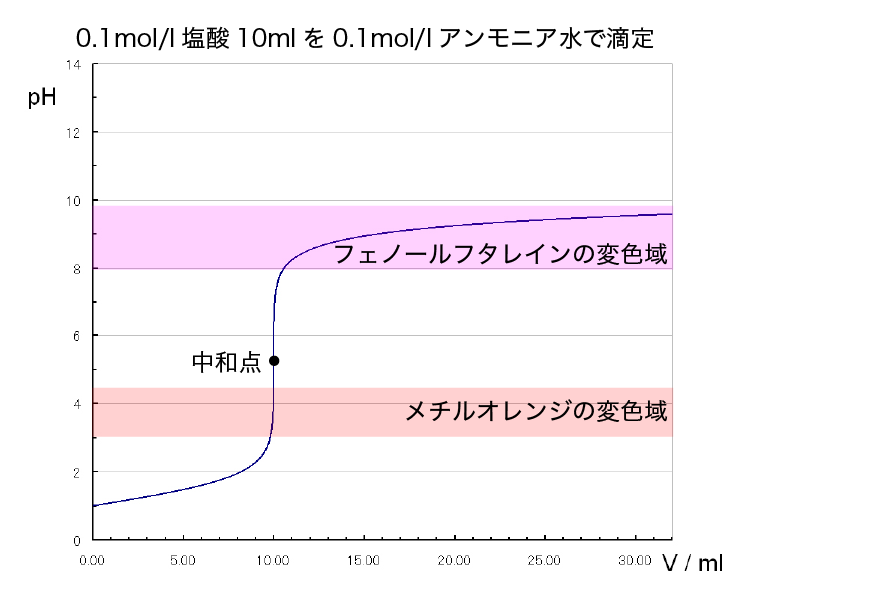
強酸と弱塩基の滴定
次は塩酸をアンモニア水で滴定するときの指示薬を選びます。
この滴定では、pHジャンプが酸性寄りにあります。
他の滴定で使ってきたフェノールフタレインは中和点を過ぎた後に変色してしまうので、この滴定では使用できません。
ですから、この滴定ではメチルオレンジを使います。
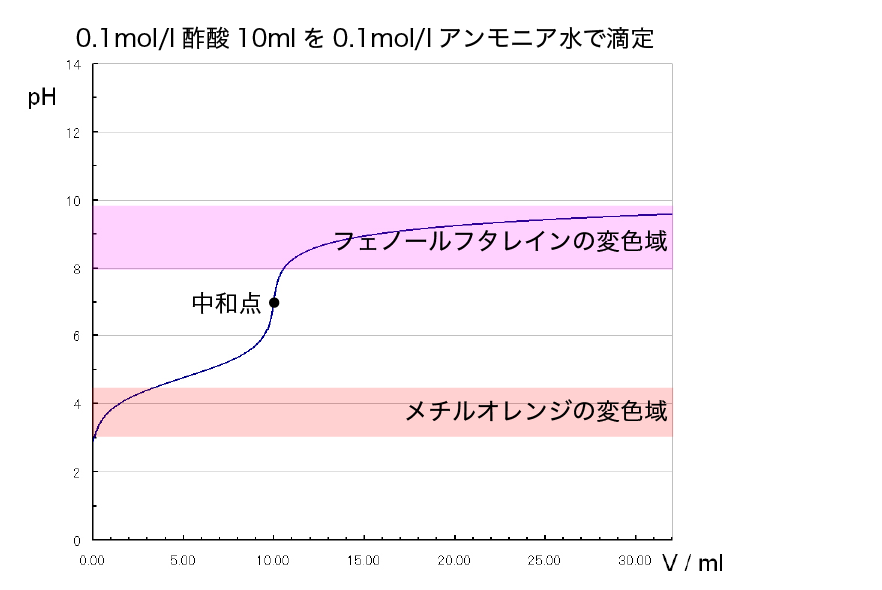
弱酸と弱塩基の滴定
最後に酢酸とアンモニア水で滴定した時のことを考えます。
滴定曲線を見てもらうとわかるように、弱酸と弱塩基の滴定ではpHジャンプの範囲がかなり狭いです。
ですから、指示薬を使って中和点を検出することは不可能です。
指示薬を使って中和滴定するときはどちらか一方が強酸・強塩基である必要があります。
最後に
YouTubeに面白い中和滴定の動画があったので紹介します。
カルピス原液を何倍にするとカルピスウォーターになるのか 滴定してみた【ガチ実験シリーズ】