電子軌道とは
電子軌道は高校化学の範囲じゃなかったような気がしますが,覚えておくと遷移元素や共有結合などが理解しやすくなると思います。
ということで今回は電子軌道について少しまとめたいと思います。
もくじ
概要
電子殻はいくつかの電子軌道(オービタル)に分かれています。
軌道と言っても,決まった道筋がある訳ではないらしいですが,電子軌道の本質について書き出すと大変なので今回は割愛します。
電子軌道には主に2つ重要な決まりがあります。
1つ目はパウリの排他原理,2つ目はフントの規則です。
パウリの排他原理
ひとつの電子軌道に電子は2つまでしか入れない。この2つの電子はスピンの方向が違う。これがパウリの排他原理です。
スピンについては,これまた難しい概念なので今回はとりあえず電子の状態のことだと思っておけば大丈夫です。
スピンの方向性は2つで,↑と↓で表します。
フントの規則
エネルギー準位の等しい電子軌道には,電子は分かれて入る。これがフントの規則です。
下の図のように,まずは1個ずつ分かれて入ります。
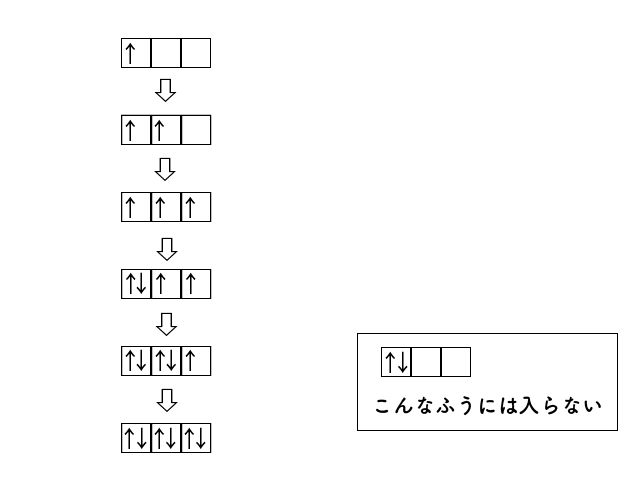
以上が,電子軌道で最低限押さえておきたいと思うポイントです。
K殻から見ていくよ
それでは,一番内側のK殻から,どんな電子軌道があるのか見ていきます。
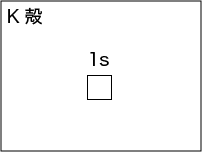
K殻
K殻には,球形のs軌道だけがあります。
だから,K殻には電子が2個まで入れます。
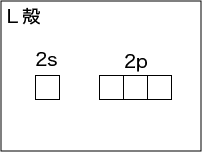
L殻
L殻には,s軌道に比べてp軌道があります。p軌道には3種類あります。よってL殻には,
2(1+3)=8 個まで電子が入れます。
単に”s軌道”と呼んでしまうと,どの電子殻のものか分からないので,主量子数(K殻から順に1,2,3,4…とつけられている)をつけて 1s軌道,2s軌道,2p軌道…というように呼びます。
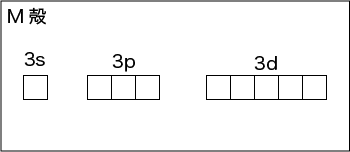
M殻
M殻には,3s軌道,3p軌道に加えて3d軌道があります。d軌道には5種類あります。よってM殻には,
2(1+3+5)=18 個まで電子が入れます。
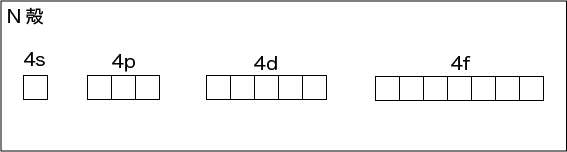
N殻
N殻には,4s軌道,4p軌道,4d軌道に加えて4f軌道があります。f軌道には7種類あります。よってN殻には,
2(1+3+5+7)=32 個まで電子が入れます。
O殻,N殻もありますが,とりあえずN殻までで。