共有結合と電子軌道
共有結合について考えるとき,電子対という言葉が出てきます。この電子対には,非共有電子対と共有電子対があります。
どんな時に非共有電子対で,どんな時に共有電子対として結合に関与するのでしょうか。今回は,電子軌道と関連づけて考えていきたいと思います。
もくじ
電子対
電子軌道1つにつき電子は2個まで入ることができます(パウリの排他原理)。
ということは,電子対は電子軌道1つが埋まったものと考えることができます。
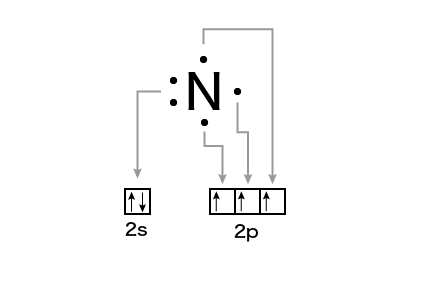
窒素(N)の場合
窒素(N)を例に挙げて見てみましょう。
窒素原子の最外殻(L殻)の電子は5個です。この電子のうち2つは電子対を作っていて,残りの3個は不対電子です。
もう1組電子対が作れそうですが,作りません。これは何故なのかっていうのを電子軌道の概念を使って考えていきます。
L殻には2s軌道と2p軌道があります。
まずはエネルギー準位の低いs軌道に電子が2つ入ります。
このs軌道に配置された2個の電子が電子対を作っているということです。
s軌道はもう満杯なので,残り3つの電子はp軌道に配置されます。
p軌道は3種類ありますが,フントの規則
によって,電子は3つに分かれて入ります。
したがって対にはならずに,不対電子となります。
だから電子対1組,不対電子3個になります。
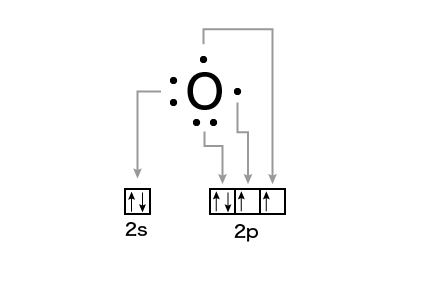
酸素(O)の場合
酸素(O)の場合についても見てみましょう。
酸素の最外殻原子はL殻の6個です。
まず2s軌道に電子が2個配置されます。
その次に3個の電子が2p軌道に分かれて入ります。
ここまでで窒素(N)と同じ感じになりました
最後の1個も2p軌道に配置されます。
よって電子対が2組,不対電子が2個になりました。
共有電子対
窒素の場合
今度は共有結合について考えてみます。
電子式で,

こんなふうに書かれても,なぜ共有電子対が3組で非共有電子対が1組の三重結合になるのかピンとこない方も多いと思います。
それぞれの窒素原子に価電子は5個あるんだから,五重結合とかにもできそうな気がします。
でもそんなことは無くて,窒素原子どうしはいつも三重結合をします。
なぜそうなるのか。これも電子軌道の概念を使って考えていきます。
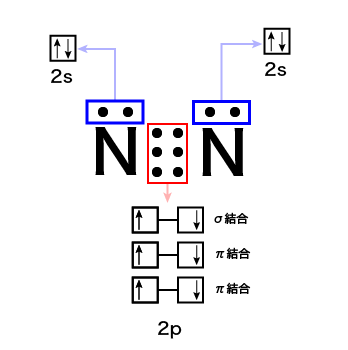
上の図で青枠で囲った電子対は,先ほど示したようにs軌道が埋まったものです。
ですからこの電子対は共有結合には関係しない非共有電子対になります。
共有結合に関わる共有電子対になるのは,フントの規則によって別々のp軌道に配置された不対電子たちです。
それぞれの原子のp軌道にはまだ電子1個分空きがあります。そこで,3つのp軌道が結合して電子を共有するという感じになります。
図にはσ結合とかπ結合とか書いてありますが,今回はそんなに重要ではないです。(気分でなんとなく書きました)
窒素についてはこのくらいにして,今度は酸素についてもみてみましょう。
酸素の場合
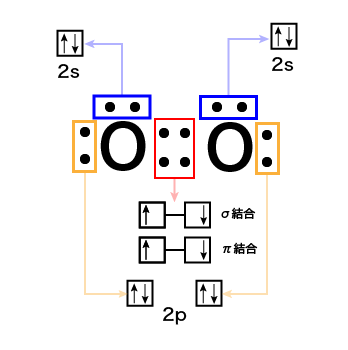
酸素も窒素と同じように,青枠の中の電子はs軌道が埋まったもので,結合に関係しない非共有電子対になります。
また酸素の場合では,p軌道も1つだけ埋まっていて,これも非共有電子対になります。
従って,結合に関わる共有電子対になるのは残り2つのp軌道にある不対電子です。
まだ空きのあるp軌道が結合して電子を共有します。
まとめ
今回は,共有結合について電子軌道の概念を使って考えてみました。
かなり簡略化して(そうでないと管理人が理解できないので)書いたので,正確性に欠けるところもあったと思いますが,
雰囲気だけでも掴めると高校の範囲の理解に役立つのではないかと思います。
それでは今回はここで終わりにします。