共有結合って何じゃい
化学結合には主に
- 共有結合・・・電子を共有して結合
- イオン結合・・・異種のイオン間に働く静電気力で結合
- 金属結合・・・金属原子が自由電子の働きで結合
の3種類があります。
今回は,共有結合について詳しく見ていきます。
もくじ
基本
水素原子の電子はK殻に1つだけです。
K殻を満たして安定するには1つ足りません。
そこで,水素原子2つがくっついてお互いの電子を共有します。
すると,それぞれの原子からみるとHeと同じ電子配置になって安定できます。
こうしてできる化学結合が共有結合です。
原子の中の価電子は2個で対になったとき安定します。
何でそうなるかは電子軌道と共有結合で書いてます。
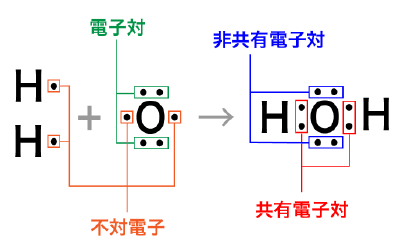
価電子が対になったものを電子対,対になっていない電子のことを不対電子といいます。
また,2つの原子に共有されている電子対を共有電子対,共有されていない電子対のことを非共有電子対といいます。
共有結合を考えるときは,最外殻の電子を元素記号の周りに”・”で表した電子式を使うと便利です。
例えば,水素原子と酸素原子が結合して水が生成されるときは以下のように表します。
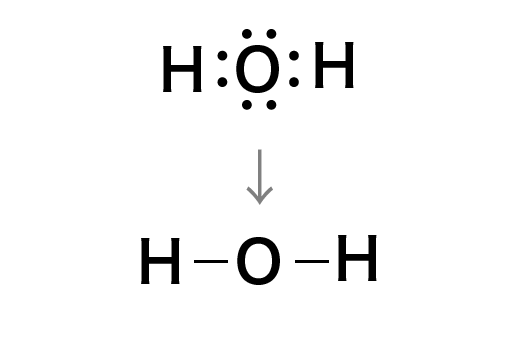
また,共有電子対を一本の線(価標)で表したものが構造式です。
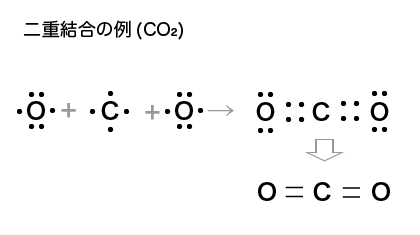
2つの原子の間の共有電子対が2組や3組になる事もあり,それぞれ二重結合,三重結合といいます。1組の時は単結合といいます。
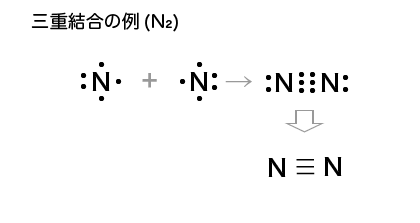
配位結合
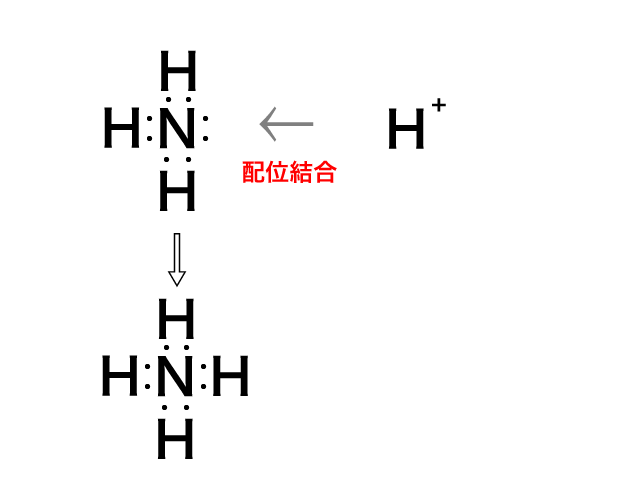
アンモニア(NH3)のNには非共有電子対が1組あります。
その非共有電子対をH+に提供すると,H+とNH3が結合して
NH4+が生成されます。
このときのNH3とH+の結合を配位結合といいます。
配位結合は結合のでき方が異なるだけで,結合自体は共有結合と同じです。
というか,多くの場合で配位結合は共有結合の仲間として扱われます。
分子の極性
結合の極性
水素(H)と塩素(Cl)が結合して塩化水素(HCl)になった時のことを考えます。
水素原子よりも塩素原子の方が電子を引き付ける力が強いので,共有電子対は塩素原子の方へ引き付けられます。
すると,水素元素はいくらか正の電荷(δ+と表します)を帯び,塩素原子はいくらか負の電荷(δ-と表します)を帯びた状態になります。
こんな感じで,共有結合している原子間の電子に偏りがある状態をその結合に極性がある,といいます。
同種の原子どうしの結合(H-Hなど)では,2つの原子で電子を引き付ける力が等しいので電子の偏りは生じません。
したがって極性はありません。
異種の原子の結合で,2つの原子間で電子を引き付ける力(電気陰性度)が異なる場合には極性があります。
電気陰性度
分子の中の原子が電子を引き付ける力の強さのことを電気陰性度といいます。
全体の傾向としては,周期表の右上の元素の値が大きい感じがします。(個人の感想です)
特にF,O,Clが大きいです。
希ガスは他の原子とほとんど結合しないので電気陰性度は省略されます。
分子の極性
二酸化炭素(CO2)のC=O結合には極性があります。
しかし,二酸化炭素の分子は直線の形をしているので,二つのC=O結合の極性が打ち消しあって分子全体では極性がありません。
水分子の場合は直線ではなく,くの字の形をしているのでH-O結合の極性は打ち消されず,分子全体で極性があります。
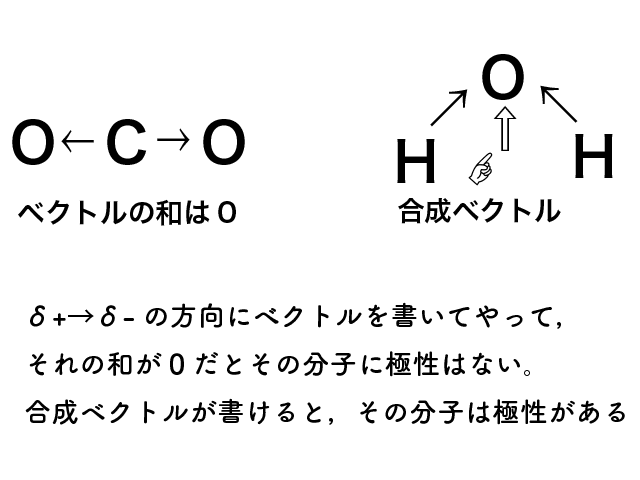
二酸化炭素のように,分子全体で極性がない分子を無極性分子, 水のように分子全体で極性がある分子を極性分子といいます。
今回はここまでにします。