化学式
化学式にはいくつか種類があります。今回は,どういった種類の化学式があって, どのように使い分けるのかについてまとめていきます。
目次
分子式
分子でできている物質について,分子を構成する原子の種類を元素記号で表し,原子の数を元素記号の右下に書き表したものが
分子式です。
原子の数が1個の時は右下の数字は省略します。
ネオン(Ne)やアルゴン(Ar)などは原子1個で安定して存在するため,原子1個で分子とみなします。このような分子を単原子分子といいます。
これに対して,酸素(O2),塩素(Cl2)などのように原子2個からなる分子を二原子分子,
オゾン(O3),二酸化炭素(CO2)のように原子3個からなる分子を三原子分子,それ以上を多原子分子といいます。
分子式の例
- 水の場合,分子は酸素(O)1個と水素(H)2個からなるのでH2O
- トリニトロトルエン(略称:TNT)の場合,分子は炭素(C)7個,水素(H)5個,窒素(N)3個,酸素(O)6個からなるのでC7H5N3O6
- パラジクロロベンゼン※の場合,分子は炭素(C)6個と水素(H)4個,塩素(Cl)2個からなるので,C6H4Cl2
※:
C6H4Cl2は,構造の違いによって
オルトジクロロベンゼン,
メタジクロロベンゼン,
パラジクロロベンゼン
の3つの異性体が存在します。詳しくは構造式を参照してください。
構造式
分子中の原子同士の結合の様子を表した化学式が構造式です。
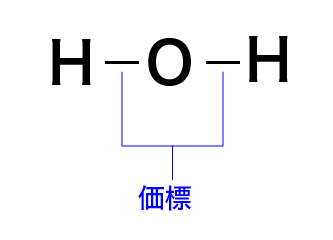
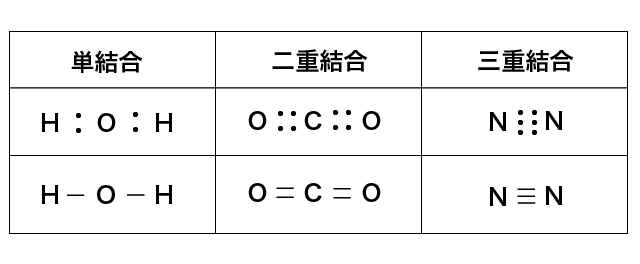
価標という線を使って分子の構造を表します。
電子式も構造式の一種で,又の名をルイス構造式といいます。
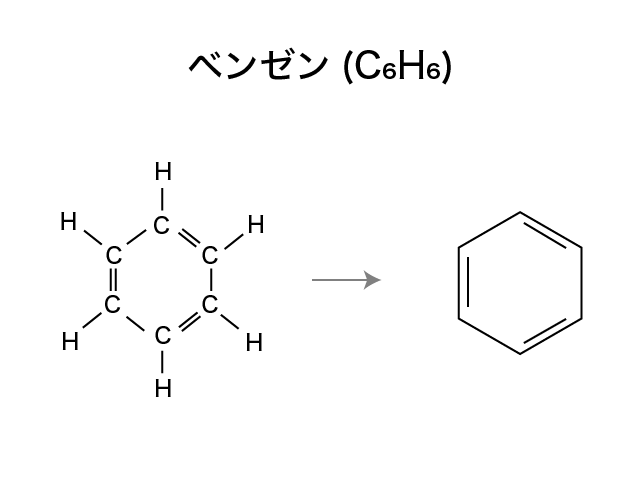
構造式では,炭素原子や水素原子が省略されることがあります。
ついでなので,オルト,メタ,パラについてもやっちゃいます。
どの炭素に結合するかで呼び方などが変わります。
ジクロロベンゼン(C6H4Cl2)を例に挙げます。
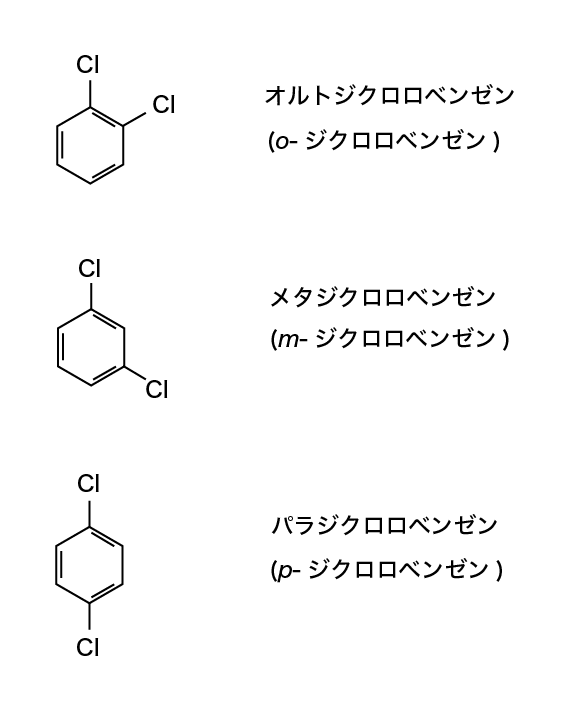
オルト:となりあう位置の炭素に結合
メタ:隣の隣(1個飛ばしたとこ)に結合
パラ:反対の位置に結合
こんな感じで,分子式は同じになってしまうものでも構造式なら違いがはっきりわかります。
イオン式
イオンを構成する原子の種類と数を分子式と同じように表し,イオンの価数を右上に書き表したものがイオン式です。
価数はプラスとマイナスをつけて表し,価数が1の場合は数字を省略して+や-で表します。
イオン式の例
- ナトリウムイオンの場合:ナトリウム原子1個からなり,陽イオンで価数は1なのでNa+
- マグネシウムイオンの場合:マグネシウム原子1個からなり,陽イオンで価数は2なのでMg2+
- 塩化物イオンの場合:塩素原子1個からなり,陰イオンで価数は1なのでCl-
- 硫化物イオンの場合:硫黄原子1個からなり,陰イオンで価数は2なのでS2-
- オキソニウムイオンの場合:水素原子3個と酸素原子1個からなり,陽イオンで価数は1なのでH3O+
- 炭酸イオンの場合:炭素原子1個と酸素原子3個からなり,陰イオンで価数は2なのでCO32-
炭酸イオン(CO32-)やオキソニウムイオン(H3O+)のように複数の原子からなるイオンを多原子イオンといいます。
組成式
塩化ナトリウムや水酸化カルシウムなどのように,イオンでできていて分子を作らない物質を表すには,構成するイオンの種類と それぞれのイオンの数を一番簡単な整数比で表した組成式を使います。イオンの価数は書きません。
組成式の例
- 塩化ナトリウムの場合,ナトリウムイオンと塩化物イオンが1:1の割合で結合しているのでNaCl
- 水酸化カルシウムの場合,カルシウムイオンと水酸化物イオンが1:2の割合で結合しているのでCa(OH)2
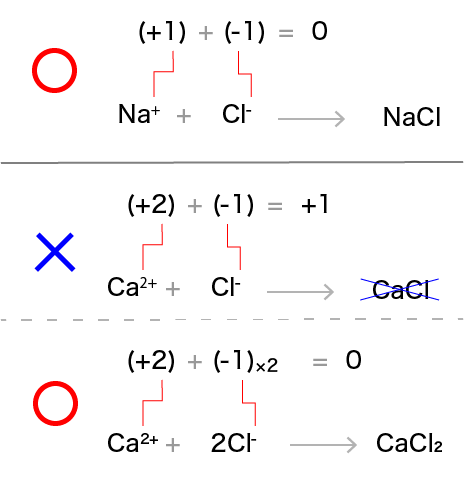
塩化ナトリウムや塩化カルシウムといった物質は電荷を帯びていません。したがって組成式を書くときは,電荷が0になるようにします。
例えば,塩化ナトリウムを構成するイオンはNa+とCl-です。これら2種類のイオンをそれぞれ1個ずつ用意します。 そして価数の和を求めると (+1)+(-1)=0です。したがってNa+とCl-の数の割合は1:1でOKということになります。よって組成式はNaClとなります。
塩化カルシウムの場合はどうでしょうか。
塩化カルシウムを構成するイオンはCa2+とCl-です。これらのイオンをまずはそれぞれ1個ずつ用意して,そして価数の和を求めると
(+2)+(-1)=+1 となります。
これでは物質全体で正の電荷を帯びていることになってしまいます。
そこでどうするのかというと,陰イオン(Cl-)をもう1個追加して,2個にします。
ここでもう一度か数の和を求めると
(+2)+2×(-1)=0となります。ということでCa2+とCl-の数の割合は1:2ということになり,組成式はCaCl2となります。
まとめ
-
物質を構成する元素の種類を表すとき
- 分子を作る物質・・・分子式
- 分子を作らない物質・・・組成式
- 分子の中の結合の様子を表すとき・・・構造式
- イオンを表すとき・・・イオン式