酸とは何か、塩基とは何か
まずはじめに、アレニウスによる酸・塩基の定義について説明し、
その後にブレンステッドとローリーによる酸・塩基の定義を説明します。
目次
水素イオンと水酸化物イオン
中学校の理科で、下の図のような実験はしたでしょうか。
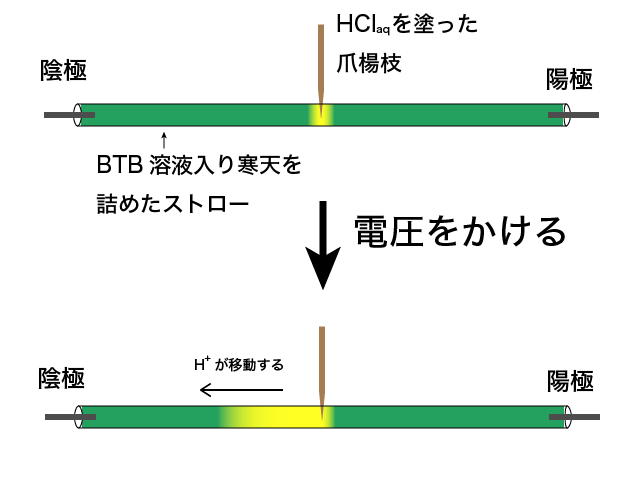
ストローの両端につけた電極に電圧をかけると、陽イオンが陰極側に、陰イオンが陽極側にそれぞれ引き寄せられます。
イオンの移動に伴い、BTB溶液が変色する範囲も変わります。
塩酸の場合は、陰極側が黄色に変色します。
陰極側に引き寄せられるのは陽イオンです。従って、塩酸に含まれる陽イオンが酸の働きをしていると考えることができます。
HClaqの陽イオンはH+ですから、H+が酸の働きをしているということです。
今度は塩基(アルカリ)である水酸化ナトリウム水溶液についてみてみます。
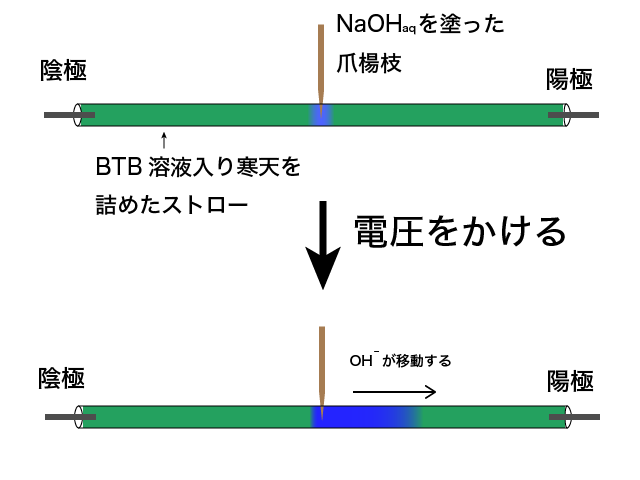
水酸化ナトリウムについて実験すると、陽極側が青色に変化します。
陽極側に引き寄せられるのは陰イオンです。従って、水酸化ナトリウム水溶液に含まれる陰イオンが塩基の働きをしていると考えることができます。
NaOHaqの陰イオンはOH-ですから、OH-が塩基の働きをしているということです。
以上の実験から、中学校では水素イオン(H+)が酸性の性質を示し、水酸化物イオン(OH-)が塩基性の性質を示す、
ということを学習したと思います。
これを踏まえて、酸・塩基の定義についてみていきましょう。
アレニウスの定義
中学校で学んだ、『水素イオンが酸性の性質を示し、水酸化物イオンが塩基性の性質を示す』ということから、酸と塩基の定義を考えた人がいます。
アレニウスは、酸と塩基をこのように定義しました。
- 酸とは、水溶液中で H+ を放出する物質である。
- 塩基とは、水溶液中で OH- を放出する物質である。
ただし、アレニウスの定義では、分子中に OH を含まないアンモニアが塩基性を示すことの説明ができなかったり、 水以外を溶媒としたときに酸・塩基の区別ができなかったりなど、問題点がありました。
そこで、これらの場合でも区別できるように新たな定義が考えられました。
ブレンステッド・ローリーの定義です。
ブレンステッド・ローリーの定義
アレニウスの定義にはいくつかの問題点がありました。
そこで、ブレンステッド(デンマーク) とローリー(イギリス) はお互い独自に、新たな定義を提案しました。
- 酸とは、H+ を他に与える物質である
- 塩基とは、H+ を他から受け取る物質である
この定義では、酸についてはアレニウスの定義と同じような感じですが、塩基については『H+を受け取るもの』
と定義されています。
H+の授受に注目して定義されているので、アレニウスの定義では説明できなかった以下の事についても説明することが可能です。
- OHを含まないアンモニアも塩基として分類できる
- HCl + NH3 → NH4のような気体同士のの反応についても、酸・塩基を区別できる。
今回はここまでです。
ありがとうございました。